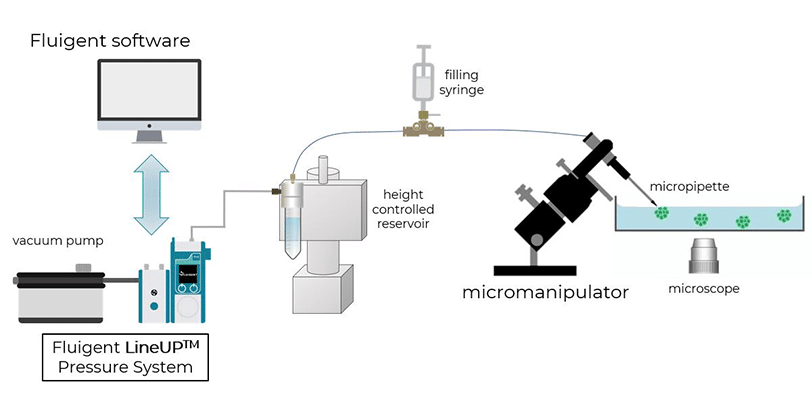
细胞与组织的微吸技术
微吸技术是一种强大且无创的方法,用于评估单个细胞或组织的生物力学特性如何影响细胞形态、对机械刺激的反应、从非肿瘤向肿瘤状态的转变,以及形态发生等过程。Fluigent 的 MFCS™-EZ 和 Flow EZ™ 压力控制器特别适用于该方法,因为其可精确施加从 10 皮牛到 1 纳牛范围内的微小力,满足实验的高灵敏度需求。
我们如何测量细胞的力学特性?
什么是细胞的力学特性?
细胞核的力学特性在多种生物过程中日益被认为至关重要。细胞核的可变形性决定了免疫细胞和癌细胞穿越组织或内皮层的能力。核力学特性的变化也可作为癌症进展、干细胞分化等过程中的新型生物标志物 [5]。
当前常用的测量方法
然而,目前用于测量细胞核黏弹性力学特性的技术往往耗时较长,通常一次只能测量一个细胞,或需要高度专业化的设备。此外,许多现有的检测方法并不能测量材料随时间变化的特性,而这是黏弹性材料的关键属性之一 [5, 6]。
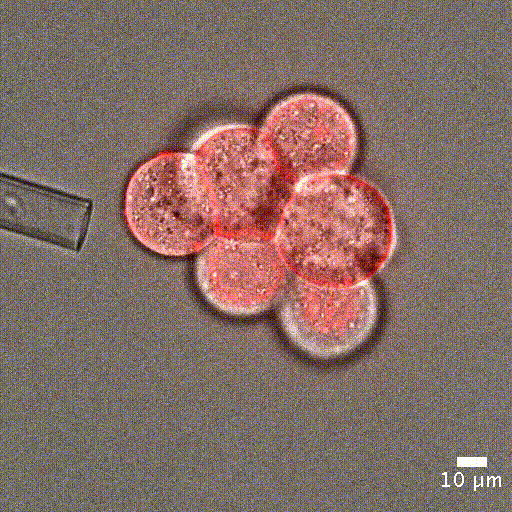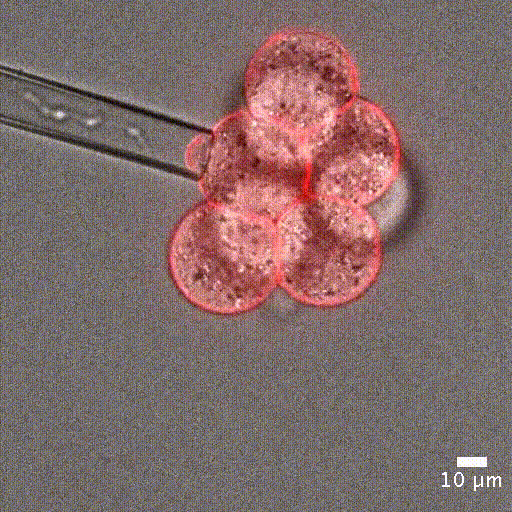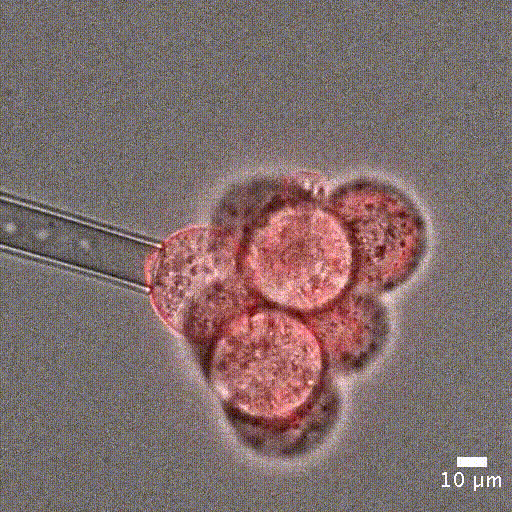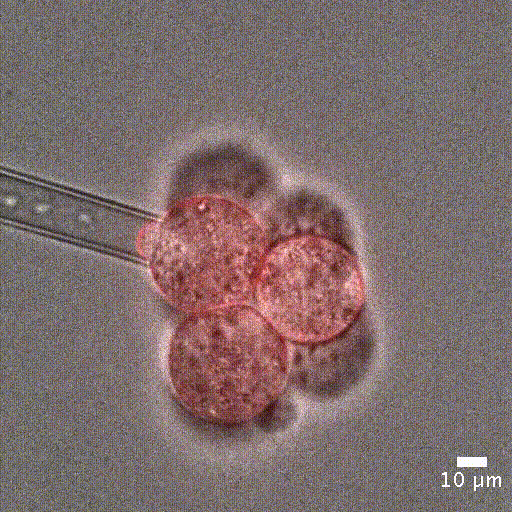
微吸技术依赖于通过微吸管对细胞施加精确且灵敏的负压,将细胞吸入管内进行分析。实验开始时,细胞首先精确地固定在微吸管管口,然后通过负压将其吸入管中。
为什么选择微吸技术?
为了量化细胞被吸入微吸管的深度,可借助显微镜追踪细胞的位置。该变形行为可以用集中参数模型来预测——模型中将细胞视为弹簧和阻尼器的组合,分别模拟其刚度和黏性特性 [5]。
在微吸实验中,细胞表现出两种变形行为:由刚度产生的线性弹性响应,以及由黏性引起的蠕变响应。不同类型的细胞具有不同的响应特性,例如白细胞的刚度低于软骨细胞。这种刚度差异会影响细胞之间的相互作用以及它们对周围环境的响应。微吸技术是一种多功能方法,可用于多种细胞类型的刚度定量分析。
定量分析细胞的力学特性对于研究和诊断多种疾病具有重要意义。由于单个细胞非常脆弱、尺寸极小,且操作所需的力非常微弱,传统材料测试方法并不适用于细胞层级的研究。
微吸技术的优势
- 无创:微吸操作可对同一样本进行重复测量,可实时监测组织中单个细胞张力的变化。这是一种强有力的工具,可追踪形态发生过程中张力的时空变化图谱(Maitre 等,Nat Cell Biol,2015)。
- 经济易用:Fluigent 提供的微吸系统结构紧凑,可适配任何显微镜,操作由直观的软件控制。相比之下,原子力显微镜(AFM)、细胞压头或光镊等竞争技术价格高昂,且需要专门培训和专用设备。
- 节省时间:得益于 Fluigent 产品的高响应性,设定压力可在毫秒级别内瞬时施加于细胞表面。细胞表面张力测量只需 3 至 5 分钟即可完成(Maitre 等,Nat Cell Biol,2015)。
- 避免操作者差异:手动微吸不仅需要高技能人员操作,而且施加压力不可量化,易引发操作者间误差。而 Fluigent 的压力控制器能以 0.1% 精度输出设定压力,确保实验重复性。
- 高灵敏度与高分辨率:Fluigent 是市面上唯一可在 0.1–10 mbar 低压区间实现 0.007 mbar 微小压力步进的仪器,能够研究如细胞骨架结构与重构等亚细胞动态过程,是共聚焦显微镜难以覆盖的领域。
微吸技术的应用
微吸管吸引技术依然是研究细胞核力学的黄金标准之一,也是最常用的工具之一,能够在不同时间尺度上提供关于细胞核黏弹性行为的重要信息。
微吸技术已被广泛用于研究多种生物物理现象,例如细胞核的力学特性、核质与染色质的分离,以及染色质的拉伸行为 [5]。
细胞力学特性测量:许多生物过程都伴随着细胞刚度的变化,例如细胞进入有丝分裂阶段 [1]、肿瘤细胞向癌前期转变 [2]、红细胞感染疟原虫 [3]。这些变化发生在单细胞尺度,因此需要高精度的测量方法来准确量化细胞刚度。
双吸管微吸实验是细胞吸引装置的扩展版,可通过分离接触中的细胞,评估细胞-细胞界面上,细胞之间张力与细胞-培养基张力的相对贡献(Maitre 等,Science,2012)。
单细胞操作:微吸技术可以精确定位单个细胞或细胞团,单细胞定位对于单细胞分析或克隆细胞系的建立至关重要。
组织内部张力异质性:在单细胞层面对细胞张力进行评估,可以绘制组织的张力空间分布图。这对于研究驱动组织形态发生或胚胎发育的力学机制尤其有效(Maitre 等,2016,Nature)。
体外诊断:在细胞分辨率下测量刚度,是发现显微镜下无法观察或察觉的异常行为的有力工具。例如,尽管受精后数小时内,可存活与不可存活的胚胎在形态上无法区分,但其力学特性已能预测其发育活力 [4]。
微吸技术成套解决方案

微流控压力控制器 , Flow EZTM

微流控软件控制系统 , LINK
实时控制与实验自动化软件 , OxyGEN

数字高速显微镜

微吸实验整套解决方案
如需了解更多信息或进行技术探讨
相关文献
[1] Théry M, Bornens M, Get round and stiff. 2008, HFSP J, 2(2):65-71.
[2] Tavares S et al, actin stress fiber organization promotes cell stiffening and proliferation of pre-invasive breast cancer cells. 2017, Nat Commun. 8:15237.
[3] Guo Q et al, Microfluidic biomechanical assay for red blood cells parasitized by Plasmodium falciparum. 2012, Lab Chip; 12(6):1143-50.
[4] Yanez LZ et al, human oocyte developmental potential is predicted by mechanical properties within hours after fertilization, 2016, Nat Commun. 7:10809
[5] Davidson, P.M. et al. (2019) “High-throughput microfluidic micropipette aspiration device to probe time-scale dependent nuclear mechanics in intact cells,” Lab on a Chip, 19(21), pp. 3652–3663. Available at: https://doi.org/10.1039/c9lc00444k.
[6] González-Bermúdez, B., Guinea, G.V. and Plaza, G.R. (2019) “Advances in micropipette aspiration: Applications in cell biomechanics, models, and extended studies,” Biophysical Journal, 116(4), pp. 587–594. Available at: https://doi.org/10.1016/j.bpj.2019.01.004.
客户出版物精选
Guevorkian K,Maître JL.Micropipette aspiration: A unique tool for exploring cell and tissue mechanics in vivo.MethodsCellBiol. 2017;139:187-201
Maître JL et al, Asymmetric division of contractile domains couples cellpositioning and fate specification, Nature. 2016 Aug 18;536(7616):344-34
Biro M, Maître JL, Dual pipette aspiration: a unique tool for studying intercellular adhesion.MethodsCellBiol. 2015;125:255-67
Porazinski S et al, YAP is essential for tissue tension to ensure vertebrate 3D body shape.Nature. 2015 May 14;521(7551):217-221
Maître JL et al, Pulsatile cell-autonomouscontractility drives compaction in the mouse embryo. Nat Cel lBiol. 2015 Jul;17(7):849-55
Maître JL et al, Adhesion functions in cell sorting by mechanically coupling the cortices of adhering cells.Science. 2012;338(6104):253-6